

金属の酸化について、下の実験1,2を行った。次の(1)~(4)に答えなさい。
実験1について、次のア、イに答えなさい。
マグネシウムの酸化を表した次の化学反応式を完成させなさい。
□+□→2MgO
1回目の加熱で、酸素と反応したマグネシウムの質量は何gか、求めなさい。
実験2について、次のア、イに答えなさい。
銅粉を加熱した時に見られる変化として適切なものを、次の1~4の中から一つ選び、その番号を書きなさい。
1.激しく熱や光を出して、黒色の物質に変化する。
2.激しく熱や光を出して、白色の物質に変化する。
3.おだやかに黒色の物質に変化する。
4.おだやかに白色の物質に変化する。
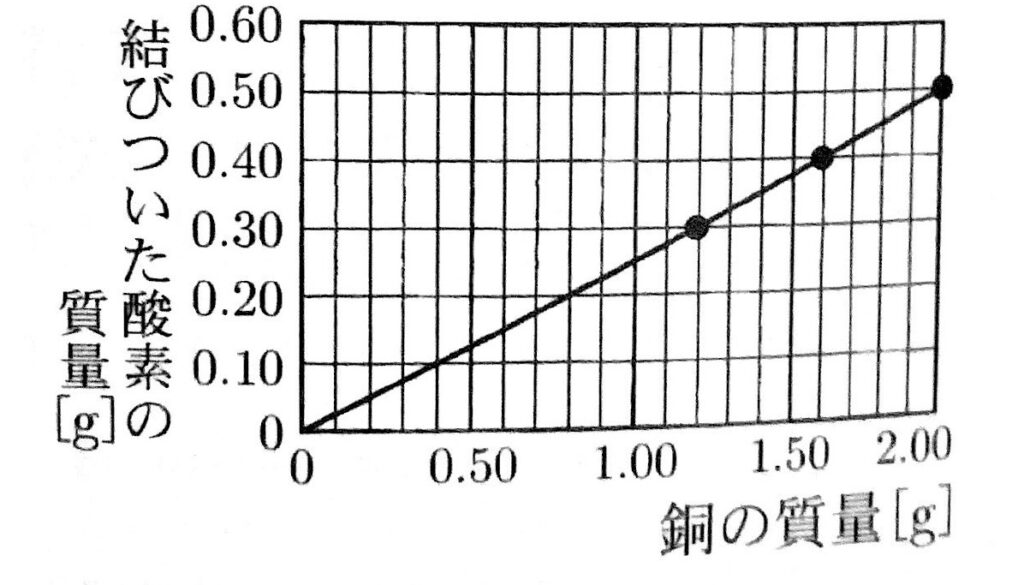
加熱後の物質の質量が一定になったときの結果をもとに、銅の質量と結びついた酸素の質量との関係を表すグラフを次に書きなさい。
下のぶんしょうは、マグネシウムと銅の質量と原子の数について考察したものである。文章中の【①】、【②】に入る語の組み合わせとして適切なものを、次の1~4の中から一つ選び、その番号を書きなさい。

1.①銅 ②マグネシウム
2.①マグネシウム ②マグネシウム
3.①銅 ②銅
4.①マグネシウム ②銅
ある生徒が実験していたところ、マグネシウムの粉末と銅粉が混ざってしまった。この混合物の質量をはかると、1.10gであった。これをステンレス皿に入れて、実験1と同様の手順で実験を行った。全体の質量が一定になったとき、物質の質量は1.50gであった。加熱する前の混合物の中にふくまれていた銅粉の質量は何gか、求めなさい。
2Mg+O2→2MgO
実験1の表より、マグネシウム1.20gに対して過不足なく反応する酸素の質量は5回目の加熱での化合物の質量から引いて
$2.00-1.20=0.80g$
だと分かる。1回目の加熱でマグネシウムと反応した酸素の質量は
$1.56-1.20=0.36g$
よって、1回目の加熱で酸素と反応したマグネシウムの質量は
$0.36\div0.80\times1.20=0.54g$
マグネシウムは2の変化をする。
銅粉の質量をxgとすると、銅粉と過不足なく酸素が反応した時の化合物の質量は、
$(x \times 1.50 \div 1.20)g$
また、マグネシウムの質量は
$(1.10-x)g$と表せるので、このマグネシウムと過不足なく酸素が反応した時の化合物の質量は
$((1.10-x)\times2.00\div1.20)g$
よって、$x \times 1.50 \div 1.20 + (1.10-x) \times 2.00 \div 1.20 = 1.50$という方程式が成り立つ。
これを求めれば$x=0.80$となる。
短期間で効果を出すなら
家庭教師のひのきあすなろ!