

次の問いに答えなさい。
酸化と還元について調べるため、次の実験1,2を行った。
[1]図1の装置を用いて、銅の粉末0.80gを薬さじでステンレス皿に広げて、ガスバーナーで3分間加熱し、加熱後の物質が冷めてからその質量を調べた。次に、銅の粉末の質量を、1.20g、1.60gにかえ、それぞれ同じように加熱後の物質の質量を調べた。表1はこのときの結果をまとめたものである。
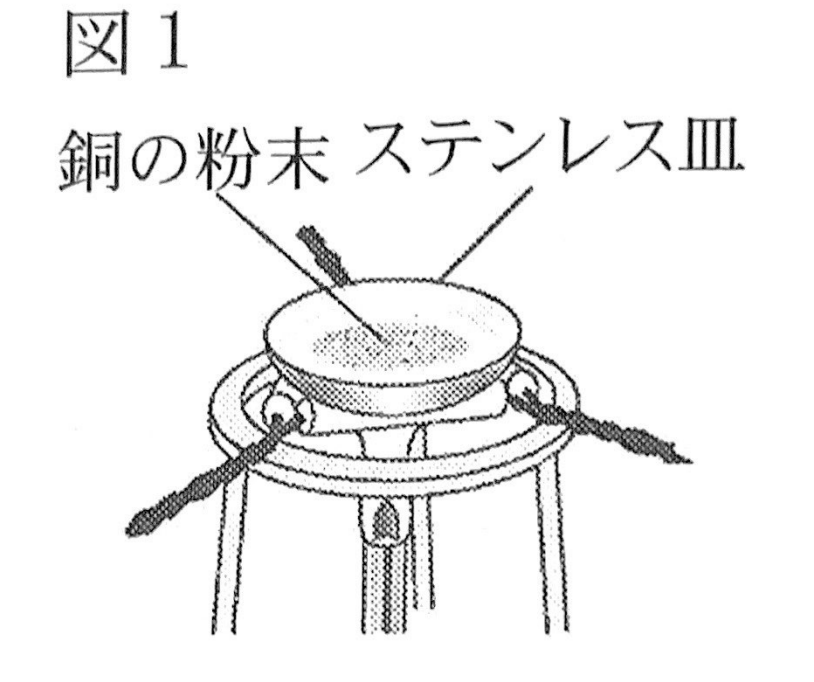
表1
| 加熱前の銅の粉末の質量[g] | 0.80 | 1.20 | 1.60 |
| 加熱後の物質の質量[g] | 0.89 | 1.34 | 1.80 |
[2]図1の銅の粉末をマグネシウムの粉末0.60g、0.90g、1.20gにそれぞれかえて、ガスバーナーで完全に酸化するまで加熱し、加熱後の物質が冷めてからそれぞれの質量を調べた。表2は、このときの結果をまとめたものである。
表2
| 加熱前のマグネシウムの粉末の質量[g] | 0.60 | 0.90 | 1.20 |
| 加熱後の物質の質量[g] | 1.00 | 1.50 | 2.00 |
[1]図2のように、赤茶色の酸化鉄の粉末と炭素の粉末の混合物が入った試験管を加熱したところ、気体が発生して石灰水が白く濁った。その後、試験管が冷めてから磁石を近づけると、混合物の一部がひきつけられた。次に、酸化鉄を酸化マグネシウムにかえて、同じように加熱したところ、反応は見られなかった。
[2]図3のように、二酸化炭素で満たしてふたをした集気びんA,Bを用意し、Aの中には火のついたマグネシウムを、Bの中には火のついたスチールウールをそれぞれ入れた。Aに入れたマグネシウムは激しく燃えて白くなり、Aの内側には黒い粒がついたが、Bに入れたスチールウールの火はすぐに消え、Bの内側に黒い粒は見られなかった。
図4は銅の粉末を加熱して完全に黒く参加した時の、加熱前の銅の粉末の質量とその銅の粉末に結び付いた酸素の質量の関係を示している。実験1について、次の(1)~(3)に答えなさい。
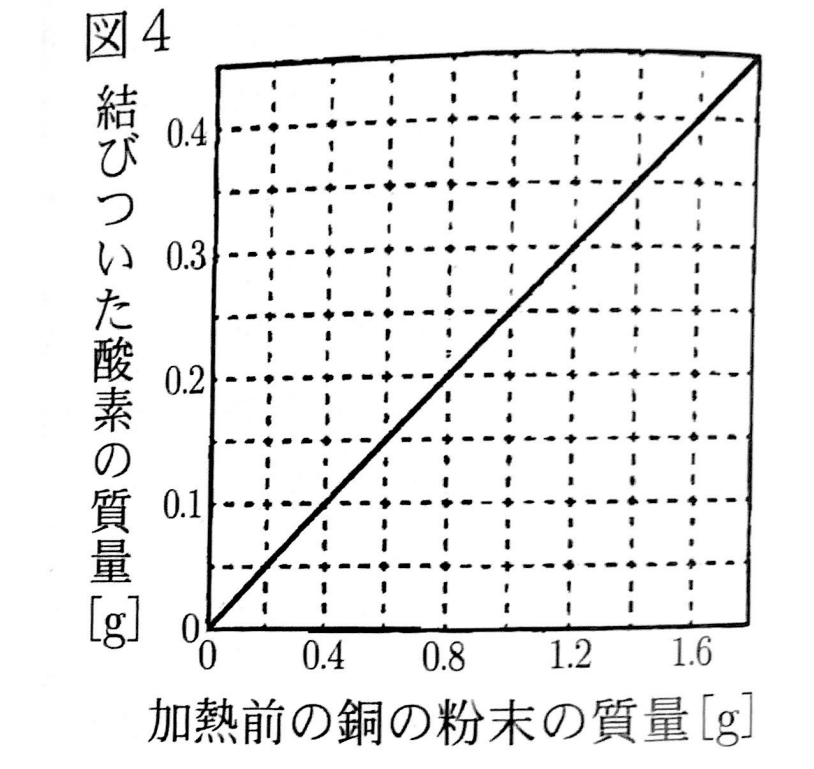
(1)図4と比較すると、表1の加熱後の物質の一部は酸化していないことがわかる。銅の粉末が酸化する割合を増やすためには、どのような操作を行えばよいか、書きなさい。ただし、使用する器具や試薬は変えないものとする。
(2)表1の銅の粉末1.60gの何%が酸化したと考えられるか、書きなさい。
(3)表2と図4から、一定の質量の酸素と結びつく、マグネシウムの質量と銅の質量の比を最も簡単な整数で書きなさい。また、その比がマグネシウム原子の質量と銅原子の質量の比としても成り立つ理由を、それぞれの酸化物の化学式を用いて書きなさい。
次の図5は、実験2について、ある中学生がまとめたものである。あとの(1)(2)に答えなさい。

(1)図5の《化学反応のモデル》は化学変化の前後で原子の数があっていません。原子の数が合うようにモデルを書きなおしなさい。ただし、◎はマグネシウム原子を、●は炭素原子を、○は酸素原子を示している。
(2)①に共通して当てはまる内容を書きなさい。また、②、③に当てはまる元素記号をそれぞれ書きなさい。
(1)(例)加熱する回数を増やす。
(2)50%
表4より、1.60gの銅の粉末は完全に酸化したときに0.4gの酸素と結びつく。
表1を見ると、1.60gの銅の粉末に結びついた酸素は(1.80-1.60=0.20g)だと分かるので、
0.2÷0.4×100=50%となる。
(3)比:Mg:Cu=3:8
表2より、(1.00-0.60=0.40g)の酸素が0.6gのマグネシウム粉末と結びついていることが分かる。
表4より、0.40gの酸素と結びつく銅の粉末の質量は1.6gである。
よって、Mg:Cu=0.6:1.6=3:8
理由:(例)MgOとCuOはどちらも酸化物中の金属原子と酸素原子の戸数の比が1:1であるから。
(1)◎,◎+○●○→◎○,◎○+●
(2)①(例)その単体を作っている元素は酸化物に含まれている元素より酸素と結びつきやすい ②Mg ③Fe